Влияние низкочастотной электростимуляции на регенерацию костной ткани

Волков Е.Е. 1, Решетняк В.К. 2, Домарацкая Е.И. 3, Волков А.Е. 4, Кучеряну В.Г. 2, Буторина Н.Н. 3, Паюшина О.В. 3.
Влияние низкочастотной электростимуляции на регенерацию костной ткани
1.Клиника преморбидных и неотложных состояний ФКУ «МУНКЦ»
им. П.В. Мандрыка МО РФ, 121002 Москва, Серебряный переулок, д.4.
2.ФГБНУ НИИ общей патологии и патофизиологии, 125315 Москва, ул. Балтийская д.8.
3.ФГБНУ Институт биологии развития им. Н.К. Кольцова РАН, 119334, Москва, ул. Вавилова, д. 26.
4.ООО «Медицинский центр ХуанДи», 125252, ул. 2-я Песчаная, д. 8, пом. 1.
Исследование выполнено на 30 крысах самцах линии Wistar (вес 330 — 360 г, возраст 3,5 мес). На экспериментальной модели повреждения бедренной кости в области тазобедренного сустава изучали влияние низкочастотной электростимуляции зоны повреждения на скорость регенерации кости. Животных разделяли на две группы. Контрольную (15 крыс) и опытную (15 крыс). У опытных животных проводили стимуляцию области травмы по 5 мин. ежедневно в течение 7 сут. 14 сут. и 21 сут. Стимуляцию осуществляли с помощью прибора «Остеон-1» генерирующего смешанный сигнал из двух импульсных напряжений разной скважности, один из которых модулирован более высокой частотой. Сигналы были не синхронизированными относительно друг друга, однополярными с изменяющимися частотами и амплитудами.
Полученные результаты свидетельствуют об эффективности электростимуляции токами низкой частоты при восстановлении костной ткани после повреждения. Морфологические исследования показали, что электростимуляция ускоряют темп регенерации поврежденной кости на всех сроках изучения (7,14,21 сут.), вызывает более выраженную интеграцию новообразованной кости со старой неповрежденной костью и способствуют формированию более мощной периостальной мозоли по сравнению с контролем.
Volkov E. E. 1, V. K. Reshetniak 2, Domaratskai E. I. 3, Volkov A. E. 4, Kucheranu V. G. 2, Butorina N. N. 3, Paulina O. V. A 3.
The effect of low frequency electrical stimulation on bone tissue regeneration
1.Clinic premorbid and emergency conditions FKU «MONKS»
them. P. V. Mandryka MO, 121002 Moscow, Silver lane,4.
2.FSBI research Institute of General pathology and pathophysiology, 125315 Moscow, the Baltic St.8.
3.FSBI Institute of biology of development. N. K. Koltsov Academy of Sciences, 119334, Moscow, Vavilov St,26.
4.LLC «Medical center HuanDi»
The study was performed on 30 male rats of Wistar line (weight 330 — 360 g, age 3.5 months). In an experimental model of damage to the femur bone in the hip joint studied the effect of low frequency electrical stimulation of the damaged area on the rate of regeneration of bone. The animals were divided into two groups. Control (15 rats) and experienced (15 rats). In the experimental animals underwent stimulation of the injury site for 5 min daily for 7 days, 14 days and 21 days. Stimulation was carried out using a device «Osteon-1» generating a mixed signal of two voltage pulse of varying duty cycle, one of which is modulated to a higher frequency. Signals were not synchronized with respect to each other, unipolar with varying frequencies and amplitudes. The obtained results show the effectiveness of the electrical stimulation currents of low frequency in the restoration of bone tissue after damage. Morphological studies showed that electrical stimulation to accelerate the regeneration of damaged bone at all stages of the study (7,14,21 day), causes a more pronounced integration of newly formed bone with the old intact bone and promote the formation of more powerful periosteal calluses in comparison with the control.
В большинстве стран мира отмечается значительное снижение смертности, вследствие этого увеличение продолжительности жизни и, соответственно, старение населения [1]. Однако улучшение деятельности здравоохранения еще не означает улучшение качества жизни, как отдельного индивидуума, так и всего общества в целом. [2]. К сожалению, прогресс, достигнутый в увеличении продолжительности жизни, не сопровождается прогрессом в уменьшении инвалидизации пожилых людей.
Следует подчеркнуть, что количество пожилых людей во всем мире стремительно увеличивается. В частности, в Российской Федерации в настоящее время доля пенсионеров по старости составляет 20,6% [3].
Остеопороз входит в число наиболее актуальных проблем современного здравоохранения. В России остеопорозом страдают 14 млн человек старше 50 лет. Еще у 20 млн обнаруживается остеопения [4,5]. Остеопороз занимает четвертое место по частоте инвалидизации после болезней сердечно-сосудистой системы, сахарного диабета и онкологических заболеваний.
Согласно данным ВОЗ, этим заболеванием страдают около 75 млн граждан Европы, США и Японии. В связи с постарением населения Европы к 2050 г. ожидается рост количества остеопоротических переломов шейки бедренной кости с 500 тыс. до 1 млн случаев ежегодно [6]. Особенно часто остеопороз встречается у пожилых женщин вследствие снижения уровня половых гормонов. Помимо переломов отмечается также устойчивый рост дегенеративно-дистрофических заболеваний суставов (остеоартроз, остеопороз, асептический некроз). Заболевания суставов сопровождаются хронической болью. Исследования, проведенные в США показали, что у женщин, испытывающих боль, падения случаются в 1,66 раз чаще [7], а это при остеопорозе в большинстве случаев неизбежно приводит к перелому костей.
Общим патогенетическим механизмом этой группы заболеваний является – нарушение структуры костной ткани, сопровождающееся сложным локальным или системным нарушением процессов костного ремоделирования.
Все вышесказанное свидетельствует о том, что проблема лечения нарушений костного ремоделирования является актуальной и в связи с нарастающим старением населения все больше актуализируется.
Накопленный опыт медикаментозного лечения дегенеративно-дистрофических заболеваний показывает, что ни один из существующих в настоящее время лекарственных препаратов не может надежно восстановить количество и качество костной ткани [8]. Кроме того, следует учитывать и тот факт, что у пожилых и старых людей, как правило, имеется целый ряд коморбидных состояний и, соответственно, отмечается вынужденная полипрагмазия. Поэтому в последние десятилетия проводится интенсивный поиск возможностей применения для стимуляции остеогенеза не фармакологических, а физических методов: переменного электромагнитного поля высокой и низкой частоты, постоянного электрического тока, ультразвука, имеющих ряд преимуществ при их практическом применении [9-11]. Преимуществами этих методов воздействия являются: безопасность, возможность длительного многофакторного воздействия, отсутствие привыкания.
Опыт лечения некроза головки бедренной кости показал, что внешние электрические сигналы могут вызывать клеточную реакцию, приводящую к реконструкции поврежденной кости [12-15].
Учитывая результаты многочисленых экспериментальных и клинических исследований свидетельствующих об эффективном действии электростимуляции на различные системы организма и, в частности, на снижение тугоподвижности суставов, спастичности мышц и подавлении болевого синдрома после переломов, ускорение регенерации кости [9, 16-18] был разработан аппарат «Остеон-1» для эффективного восстановления структуры костной ткани [13].
Цель настоящей работы — гистологическое исследование эффективности восстановления костной ткани при стимуляции поврежденной кости животных с помощью прибора «Остеон-1».
Методика
Работа выполнена на 30 крысах-самцах линии Wistar (вес 330 — 360 г, возраст 3,5 мес). Крыс содержали в стандартных условиях по 5 особей в клетке с контролируемыми режимами температуры (24 oC) и освещения (в течение 12 ч) и со свободным доступом к воде и пище. Операцию по моделированию травмы проводили под общим наркозом. Сначала животных анестезировали легким эфирным наркозом. Для более глубокого наркоза, использовали хлоралгидрат, внутрибрюшино, в дозе 300 мг/кг. Затем животное фиксировали на операционном столике, состригали шерсть в области левого бедра и скальпелем разрезали кожу и мышечную ткань. Бедренную кость в области тазобедренного сустава обнажали, просверливали бедренную кость до костномозгового канала на 8-10 мм дистальнее сутава с помощью миниатюрной стоматологической бормашины (диаметр бора 0,8 мм). После повреждения кости производили послойное ушивание мягких тканей. Животных разделяли на две группы. Контрольную (15крыс) и опытную (15 крыс). У подопытных животных с помощью прибора «Остеон-1» проводили стимуляцию области травмы по 5 мин ежедневно в течение 7 сут. (оп7), 14 сут. (оп14) и 21 дня (оп21). Для этого животных фиксировали на операционных столиках и через введенные под кожу хирургические иглы подавали смешанный сигнал из двух импульсных напряжений разной скважности, один из которых модулирован более высокой частотой. Сигналы были не синхронизированными относительно друг друга, однополярными с изменяющимися частотами и амплитудами. Катод располагался в области травмы, анод помещался на ту же лапу дистальнее. Электростимуляцию осуществляли под общим наркозом (хлоралгидрат в дозе 190-200 мг/кг, внутрибрюшинно).
Три группы животных с нанесенной травмой служили контролем (к7, к14, к21), они также располагались на препаровальных столиках, им вводились хирургические иглы, но стимуляция не осуществлялась. В каждом варианте опыта использовали по 5 животных. На следующий день по окончании исследований животные выводились из эксперимента путем цервикальной дислокации. Затем извлекали бедренные кости всех 6-ти групп, которые использовали для гистологического анализа и оценки выраженности патологического процесса и процесса остеогенеза.
Кости животных фиксировали 24 часа при комнатной температуре в 10% формалине, приготовленном на фосфатно-солевом буфере (ФСБ, 0,02М, рН7.6). Декальцинировали в 5% трихлоруксусной кислоте 48 часов, затем промывали в ФСБ и замораживали в изопентане при -400С. Далее приготавливали срезы толщиной 5 мкм. Срезы высушивали при комнатной температуре в течение 1 часа и окрашивали гематоксилин-эозином. Для гистологического анализа от каждого животного было изготовлено от 100 до 200 серийных срезов бедренной кости, сделанных в поперечном и продольном направлениях. С помощью микроскопа Олимпус (ок. 10х, об. 4х). делали микрофотографии срезов костной ткани. Морфометрический анализ костной ткани внутри раневого канала (интермедиарная костная мозоль) осуществляли с помощью программы ImageJ [19]. Площадь костной ткани, измеренной на 3-5 срезах от каждого животного, выражали в % от площади канала. Для определения достоверности различий между опытом и контролем использовали непараметрический двусторонний критерий Манна-Уитни (U-тест).
Результаты и обсуждение
Регенерация костной ткани у контрольных животных.
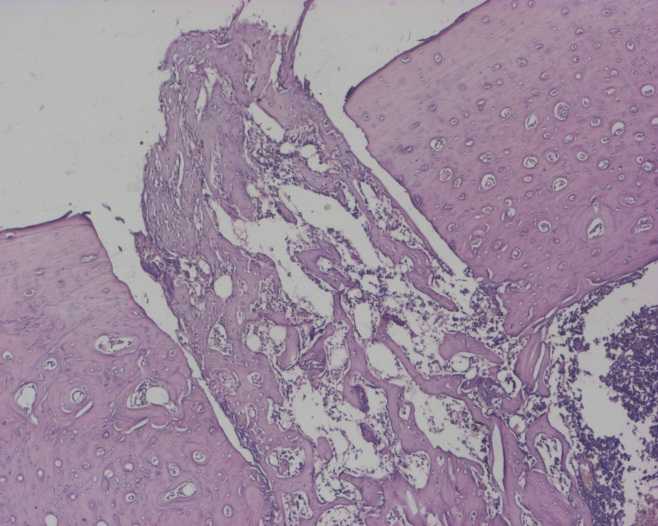
Результаты морфологических исследований свидетельствуют что, в группе контрольных животных новая кость образуется в области периоста, эндоста и костномозговой полости на 7 сутки после нанесения травмы (рис.1). Начало восстановления осуществляется в области периоста через фазу энхондрального окостенения. В этот период в области периоста происходит активная пролиферация клеток и число слоев остеогенных клеток многократно увеличивается, в то же время в надкостнице интактной кости присутствует лишь один слой этих клеток. Область повреждения заполняется молодой губчатой костью (интермедиарная мозоль).
Рис.1. Контроль 7 суток. Раневой канал заполнен губчатой костью, кроветворные клетки отсутствуют. Видна внутренняя костная мозоль.
На 14 сутки, между трабекулами интермедиарной мозоли выявляются кроветворные клетки. Внутри полости бедренной кости начинается формирование внутренней (эндостиальной) костной мозоли, характеризующейся выраженным разрастанием молодой губчатой кости с полостями, заполненными рыхлой соединительной тканью и кровеносными сосудами.
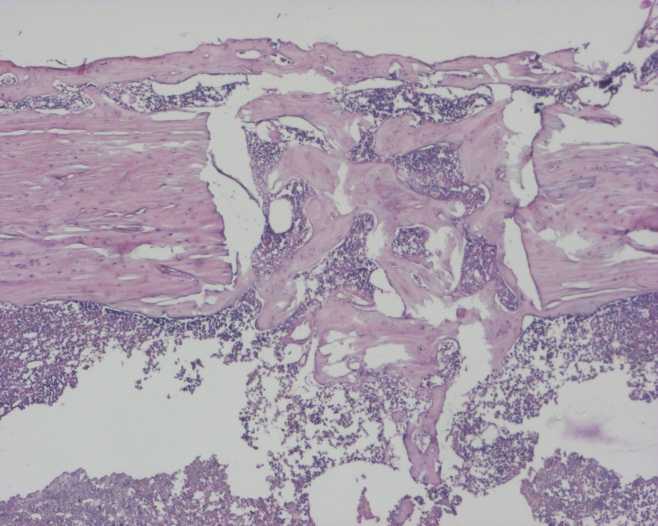
В последующий период происходит некоторое замедление процесса регенерации костной ткани. Так на 21 сутки после повреждения, по сравнению с 14 суточным периодом наблюдений, существенных изменений в морфологической картине восстановления костной ткани не отмечается, за исключением формирования наружной периостальной мозоли. В костномозговой полости присутствует эндостиальная мозоль, представленная губчатой костью, иногда пронизывающей всю полость диафиза в области повреждения. Наблюдается частичное заполнение области повреждения губчатой костью распространяющейся на поверхность бедренной кости и формирующей наружную костную мозоль. Между трабекулами губчатой кости обнаруживаются многочисленные кроветворные клетки костного мозга. (рис.2).
Рис.2. Контроль 21 сутки. Видны периостальная, эндостиальная и интермедиарная костные мозоли. Присутствуют многочисленные кроветворные клетки.
Регенерация костной ткани у подопытных животных.
На 7 сутки электростимуляции в группе подопытных животных в области повреждения развивается мощная губчатая кость и присутствуют признаки закрытия внешнего отверстия раневого канала костью. В отличие от контроля, в периосте, хондрогенез практически не выражен. В то же время отмечается распространение новообразующейся кости внутри полости кости до ее неповрежденной стенки (эндостиальная мозоль), а интермедиарная мозоль, начинает интегрироваться со старой пластинчатой костью, окружающей повреждение, способствуя укреплению поврежденной кости. В отличие от контрольных животных уже на 7 сутки электростимуляции отмечается наличие кроветворных клеток внутри трабекул вновь образованной кости. Как было сказано выше такой эффект у контрольных животных отмечается только на 14 сутки. Эти результаты свидетельствуют о большей скорости регенерации по сравнению с костной тканью контрольной группы животных. (рис.3).
Рис.3. Опыт 7 суток. Формирование интермедиарной и эндостиальной мозолей. Область повреждения заполнена губчатой костью. Между трабекулами новообразованной костной ткани присутствуют кроветворные клетки.
К 14-м суткам процесс регенерации активно развивается. Канал повреждения полностью заполняется довольно мощной губчатой костью. В её полостях появляются многочисленные кроветворные клетки. Сформированная кость уже интегрируется со стенкой раневого канала.
На 21-е сутки электростимуляции отмечается укрепление наружных стенок раневого канала новообразованной костной тканью. Наблюдается формирование уже хорошо выраженной, мощной периостальной костной мозоли. Она простирается на значительное расстояние вдоль кости. Это убедительно свидетельствует, что электростимуляция значительно ускоряет ее образование, по сравнению с контролем. На существенную активизацию остеогенеза указывает также формирование нескольких слоев остеобластов в надкостнице (рис. 4).
Рис.4. Опыт 21 сутки.Раневой канал полностью закрыт. Видна мощная периостальная костная мозоль.
Полученные результаты морфологического исследования позволяют прийти к заключению о том, что через 21 сут. от момента начала эксперимента в группе контрольных животных отмечается относительно слабое костеобразование внутри канала повреждения, хотя костная мозоль на поверхности кости сформирована, а внутренняя костная мозоль сохраняется. У подопытных животных, в отличие от контрольной группы, наблюдается более интенсивное костеобразование — более мощная наружная мозоль и значительно большая степень закрытия раневого канала.
Как уже было сказано выше одним из эффективных методов воздействия на регенерацию костной ткани является электрическая и электромагнитная стимуляция.
Регенерация кости в значительной степени зависит от успешного завершения воспалительного процесса, васкуляризации в месте повреждения, секреции остеогенных и хондрогенных факторов, ремоделирования внеклеточного матрикса в поврежденной и вновь образованной костной ткани. Успешное завершение воспалительного процесса, васкуляризация в месте повреждения невозможны без нормализации микроциркуляции. Электростимуляция играет ведущую роль в устранении дизрегуляции микроциркуляторного звена кровообращения как во всем организме, так и в костных тканях. Это системный процесс [17].
Активирующее влияние электрического потенциала на клетки организма обусловлено изменением концентрации ионов по обе стороны клеточной мембраны, что приводит к изменению функционального состояния клетки. Это происходит в результате трансмембранного сигналинга, активации ионных каналов и стимуляции или блокады различных рецепторов [20]. Электрическое или электромагнитное поля способны усиливать экспрессию генов, синтез ростовых факторов и, в частности факторов, участвующих в энхондральном окостенении, через ауто- и паракринные сигналы. При этом может усиливаться продукция морфогенетического белка кости (MBP), трансформирующего фактора роста (TGF-β), инсулиноподобного фактора (IFG II), что увеличивает продукцию внеклеточного матрикса хряща и кости [21]. In vitro показано, что воздействие импульсного электромагнитного поля на культивируемые in vitro остеобласты линии MC3T3-E1 стимулирует образование костной ткани, что выражается в повышенной активности щелочной фосфатазы и отложении минерализованного матрикса [22]. На сегодняшний день можно считать доказанным, что интенсивность остеорепарации при электростимуляции обусловлена околоэлектродными электрохимическими, биофизическими и биохимическими реакциями и индуцированными ими общими нейрогуморальными воздействиями на остеогенез.
Наиболее сильное раздражающее действие на биологические системы оказывает импульсный ток, так как импульсные воздействия в определенном заданном ритме соответствуют физиологическим ритмам функционирующих органов и систем [23]. Импульсный ток низкой частоты успешно применяется в ортопедии для стимуляции регенеративных процессов в кости при переломах [11,24,25].
Клиническое применение электрического и электромагнитного стимулирования улучшает регенерацию кости на клеточном уровне. Это проявляется во взаимодействии клеток с окружающей средой, воздействии факторов роста и работе системы сигнальной трансдукции [21].
Полученные в настоящей работе результаты свидетельствуют об эффективности электростимуляции токами низкой частоты, генерируемыми прибором «Остеон-1», для восстановления костной ткани после повреждения. Морфологические исследования показали, что данные параметры электростимуляции ускоряют темп регенерации поврежденной кости, вызывают более выраженную интеграцию новообразованной кости со старой неповрежденной костью и способствуют формированию более мощной периостальной мозоли по сравнению с контролем.
Список литературы
- McMichael A.J., McKee M., Shkolnicov V., Valkonen T. Mortality trends and setbacks: global convergence or divergence? 2004; 363: 1155 – 1159.
- Turner J.A. Research on cognitive-behavioral therapies for older adults with chronic pain: In its infancy, but growing. 2013; 154: 771 – 772.
- Щегорцов А.А. Стратегическое планирование качества жизни пожилых граждан. Вестник Российской ассоциации геронтологов и гериатров. 2014; 1: 14 – 20.
- Михайлов Е.Е., Беневоленская Л.И. В кн.: Руководство по остеопорозу. Под ред. Л.И. Беневоленской. М: БИНОМ 2003; 10—55.
- Лесняк О.М. Аудит состояния проблемы остеопороза в Российской Федерации. Профилактическая медицина. 2011; 2: 7-10.
- Руденко Э.В., Буглова А.Е., Руденко Е.В., Самоховец О.Ю. Медикаментозное лечение остеопороза у взрослых. Учебно-методическое пособие, Минск: БелМАПО, 2011 — 22 с.
- Leveille S.G. Musculoskeletal pain and risk for falls in jlder disabled women living in the community. J.Am.Geriatr. Soc. 2002; 50: 671 – 675.
- Чернов, Ю.Н., Пешехонова Л.К., Батищева Г.А. Остеопороз: критические звенья патогенеза и пути фармакологической коррекции. https://medi.ru/doc/ В мире лекарств. 2000;
- Резник Л.Б., Рожков К.Ю., Ерофеев С.А. и др. Применение физических факторов для оптимизации костной регенерации (обзор литературы). Журнал клинической и экспериментальной ортопедии им. Г.А. Илизарова. 2015; 1: 89-95.
- Городниченко А.И., Городецкий И.Г.. Решетняк В.К.. Турзин П.С., Усков О.Н. Интерактивная электростимуляция в лечении травматолого-ортопедических больных. Кремлевская медицина. Клинический вестник. 2005; 4: 76-81.
- Городниченко А.И., Городецкий И.Г.. Решетняк В.К.. Турзин П.С., Ушаков И.Б., Усков О.Н. Применение интерактивной электростимуляции у больных с переломами лодыжек в постоперационном периоде. Профилактическая медицина. 2009; 12 (1): 38 -41.
- Волков Е.Е., Кэцинь Хуан, Асептический некроз головки бедренной кости. Безоперационное лечение. – М., OOO “Пиар-пресс”. 2010;
- Волков Е.Е. Возможная альтернатива эндопротезированию тазобедренных суставов при асептическом некрозе головки бедренной кости, Рефлексотерапия и комплементарная медицина. 2013; 3: 26-34.
- Mahmud F.A., Hastings G.W., Martini M. Model to characterize strain generated potentials in bone. J.Biomed. Eng. 1988; 10 (1): 54-56.
- Huang L.Q, He H.C., He C.Q., et al. Clinical update of pulsed electromagnetic fields on osteoporosis. J. Orthop. Res. 2008; 26 (9): 1250-125
- Дуринян Р.А., Решетняк В.К., Зарайская С.М. Нейрофизиологические механизмы иглоукалывания. Мед. Реф. Журнал. 1981; 5: 13-20.
- Решетняк В.К., Кукушкин М.Л., Мeйзеров Е.Е. Нейрофизиологическое обоснование параметров электроакупунктурной, электропунктурной и чрезкожной электростимуляции при лечении болевых синдромов. В кн: Итоги и перспективы развития традиционной медициы в России. Москва. 2002: 122 – 125.
- Ткаченко С.С., Руцкий В.В. Электростимуляция остеорепарации. Л.: Медицина. 1989: 207 с.
- Abramoff M.D., Magelhaes P.J., Ram S.J. Image processing with ImageJ. Biophoton. Int. 2004; 11: 36–42.
- Aaron R.K., Boyan B.D., Ciombor D.M., et al. Stimulation of growth factor synthesis by electric and electromagnetic fields. Bioelectromagnetics. 2004; 25 (2): 134-41.
- Haddad J.B., Obolensky A.G., Shinnick P. The biologic effects and the therapeutic mechanism of action of electric and electromagnetic field stimulation on bone and cartilage: new findings and a review of earlier work. Electromagn Biol Med. 2007; 26 (3): 167-1
- Diniz P., Shomura K., Soejima K., Ito G. Effects of pulsed electromagnetic field (PEMF) stimulation on bone tissue like formation are dependent on the maturation stages of the osteoblasts. J. Vet. Med. A Physiol. Pathol. Clin. Med. 2002; 49 (1): 33-3
- Решетняк В.К. Нейрофизиологические основы боли и рефлекторного обезболивания. В кн: Итоги науки и техники. Физиол.человека и животных. Москва. 1985; 29: 39-109.
- Schwartz Z, Fisher M, Lohmann CH, et al. Osteoprotegerin (OPG) production by cells in the osteoblast lineage is regulated by pulsed electromagnetic fields in cultures grown on calcium phosphate substrates. Chin. Med. J. (Engl). 2008; 121(20): 2095-209
- Chen K., Hao J., Noritake K., et al. Low intensity pulsed ultrasound stimulation (LIPUS) has been clinically applied to promote bone fracture healing in the orthopedic field. Open Journal of Regenerative Medicine. 2013; 2 (1): 8-14.
References
- McMichael A.J., McKee M., Shkolnicov V., Valkonen T. Mortality trends and setbacks: global convergence or divergence? Lancet. 2004; 363: 1155 – 1159.
- Turner J.A. Research on cognitive-behavioral therapies for older adults with chronic pain: In its infancy, but growing. Pain. 2013; 154: 771 – 772.
- Shegortcev А.А. Strategic planning the quality of life of older citizens. Vestnik Rosiiskoy asociacii gerontologov i geriatrov. 2014; 1: 14 – 20.
- Мihailov Е.Е., Benevolenskai L.I. In book: Guide to osteoporosis. Ed: Benevolenskai L.I. М: BINOM 2003; 10—55.
- Lesnyak О.М. Audit & problems of osteoporosis in the Russian Federation. Profilaktisheskai medicina. 2011; 2: 7-10.
- Rudenko A.V., Buglova А.Е., Rudenko Е.V., Samohovetc О.U. Drug treatment of osteoporosis in adults. Textbook. Мinsk: BеlМАPО, 2011 — 22 с.
- Leveille S.G. Musculoskeletal pain and risk for falls in jlder disabled women living in the community. J.Am.Geriatr. Soc. 2002; 50: 671 – 675.
- Chernov U.N., Pechehonova L.К., Baticheva G.А. Osteoporosis: a critical pathogenesis and ways of pharmacological correction. V mire lekarstv. 2000;
- Reznik L.B., Rochkov K.U., Еrofeev С.А. et al. The application of physical factors for the optimization of bone regeneration (literature review). Jurnal klinicheskoi I eksperimentalnoy ortopedii of name G.A. Ilizarova. 2015; 1: 89-95.
- Gorodnichenko А.I., Gorodeckiy I.G., Rechetniak V.К., Тurzin P.S., Uskov О.N. Interactive electrical stimulation in the treatment of trauma and orthopedic patients. Кremlevskai medicina. Clinichtskii vestnik. 2005; 4: 76-81.
- Gorodnichenko А.I., Gorodeckiy I.G., Rechetniak V.К., Тurzin P.S., Uchakov I.B., Uskov О.N. The interactive application of electrical stimulation in patients with fractures of the ankles in the postoperative period. Profilacticheskai medicina. 2009; 12 (1): 38 -41.
- Volkov Е.Е., Кecin Huan. Aseptic necrosis of the femoral head. Non-surgical treatment.– М., OOO “Piar-press”. 2010; 128.
- Volkov Е.Е. A possible alternative to hip replacement in avascular necrosis of the femoral head. Refleksoterapia I komplementarnai medicina. 2013; 3: 26-34.
- Mahmud F.A., Hastings G.W., Martini M. Model to characterize strain generated potentials in bone. J.Biomed. Eng. 1988; 10 (1): 54-56.
- Huang L.Q, He H.C., He C.Q., et al. Clinical update of pulsed electromagnetic fields on osteoporosis. J. Orthop. Res. 2008; 26 (9): 1250-1255.
- Durinian R.А., Rechetniak V.К., Zaraiskai S.М. Neurophysiological mechanisms of acupuncture.Мed. Ref. J. 1981; 5: 13-20.
- Rechetniak V.К., Кuкuchkin М.L., Мeizerov Е.Е. Neurophysiologic basis of parameters electroacupuncture, electroacupuncture and transcutaneous electrical stimulation in the treatment of pain syndromes. V knige: Itogi I perspektivi razvitia tradicionnoi medicini v Rosii. Моskva. 2002: 122 – 125.
- Ткаchenko S.S.,Ruckii V.V.Electrical stimulation osteoreparation.L.: Medicina. 1989: 207 p.
- Abramoff M.D., Magelhaes P.J., Ram S.J. Image processing with ImageJ. Biophoton. Int. 2004; 11: 36–42.
- Aaron R.K., Boyan B.D., Ciombor D.M., et al. Stimulation of growth factor synthesis by electric and electromagnetic fields. Bioelectromagnetics. 2004; 25 (2): 134-41.
- Haddad J.B., Obolensky A.G., Shinnick P. The biologic effects and the therapeutic mechanism of action of electric and electromagnetic field stimulation on bone and cartilage: new findings and a review of earlier work. Electromagn Biol Med. 2007; 26 (3): 167-177.
- Diniz P., Shomura K., Soejima K., Ito G. Effects of pulsed electromagnetic field (PEMF) stimulation on bone tissue like formation are dependent on the maturation stages of the osteoblasts. J. Vet. Med. A Physiol. Pathol. Clin. Med. 2002; 49 (1): 33-37.
- Rechetniak V.К., Neurophysiological bases of pain and reflex analgesy. V knige: Itogi nauki I techniki. Physiol. Cheloveka I chivotnich. Моsкvа. 1985; 29: 39-109.
- Schwartz Z, Fisher M, Lohmann CH, et al. Osteoprotegerin (OPG) production by cells in the osteoblast lineage is regulated by pulsed electromagnetic fields in cultures grown on calcium phosphate substrates. Chin. Med. J. (Engl). 2008; 121(20): 2095-2099.
- Chen K., Hao J., Noritake K., et al. Low intensity pulsed ultrasound stimulation (LIPUS) has been clinically applied to promote bone fracture healing in the orthopedic field. Open Journal of Regenerative Medicine. 2013; 2 (1): 8-14.
Сведения об авторах:
- Волков Евгений Егорович — заведующий отделением традиционной медицины Клиники преморбидных и неотложных состояний ФКУ «МУНКЦ» им. П.В. Мандрыка МО РФ, главный врач ООО « Медицинский центр ХуанДи», кандидат медицинский наук.
- Решетняк Виталий Кузьмич- заведующий лабораторией общей патологии нервной системы ФГБНУ НИИ общей патологии и патофизиологии, доктор медицинский наук, профессор, член-корреспондент РАН.
- Кучеряну Валериан Григорьевич- главный научный сотрудник лаборатории общей патологии нервной системы ФГБНУ НИИ общей патологии и патофизиологии, доктор медицинских наук.
- Домарацкая Елена Ивановна — заведующая лабораторией клеточных и молекулярных основ гистогенеза ФГБНУ Института биологии развития им. Н.К. Кольцова РАН, доктор биологических наук.
- Паюшина Ольга Викторовна — старший научный сотрудник лаборатории клеточных и молекулярных основ гистогенеза ФГБНУ Института биологии развития им. Н.К. Кольцова РАН, кандидат биологических наук
- Буторина Нина Николаевна — старший научный сотрудник лаборатории клеточных и молекулярных основ гистогенеза ФГБНУ Института биологии развития им. Н.К. Кольцова РАН, кандидат биологических наук
- Волков Андрей Евгеньевич – сотрудник ООО « Медицинский центр ХуанДи»