Современная лабораторная диагностика остеопороза.

Значимость заболевания в современном обществе и медицине определяется его распространённостью среди населения, тяжестью течения и исходов, экономическими потерями больного, семьи и общества в целом. Остеопороз (ОП) — системное метаболическое заболевание скелета, характеризующееся снижением массы костной ткани и нарушением микроархитектоники её строения, что снижает прочность кости и увеличивает риск переломов. По мнению экспертов ВОЗ, ОП сегодня — одно из наиболее распространённых заболеваний, которое наряду с инфарктом миокарда, инсультом, раком и внезапной смертью занимает ведущее место в структуре заболеваемости и смертности населения.
Результаты многочисленных исследований убедительно доказали, что костная масса является главной детерминантой механических свойств костной ткани и определяет 75-80% её крепости. Риск переломов прямо связан с абсолютными значениями минеральной плотности костной ткани (МПКТ) позвоночника и шейки бедра, а костная денситометрия — единственный достоверный метод, позволяющий установить степень снижения костной массы. Риск перелома увеличивается с возрастом, который главным образом связан у пожилых людей с низкой МПКТ. Риск перелома бедра возрастает в 2-3 раза при каждом снижении МПКТ шейки бедра на одно стандартное отклонение в соответствии с критериями ВОЗ.
Патогенез остеопороза.
ОП сегодня широко используется как модель фундаментальных исследований в изучении молекулярных механизмов межклеточного взаимодействия. ОП – многофакторное заболевание, в основе которого лежат процессы нарушения костного ремоделирования с повышением резорбции костной ткани и снижением костеобразования. Ремоделирование костной ткани начинается с резорбции, осуществляемой в процессе остеокластогенеза с образованием полости резорбции. Остеобласты (ОБ) «атакуют» полость резорбции, где строят новый костный матрикс для последующей минерализации. Оба процесса костеобразования тесно связаны. Образование кости превышает резорбцию в течение роста скелета, и наоборот, резорбция превалирует в течение последующего периода жизни человека. Оба процесса костеобразования являются результатом тесного клеточного взаимодействия ОБ иостеокластов (ОК), которые берут начало от предшественников различных клеточных линий, а именно: ОБ — из мезенхиальных стволовых клеток, ОК — из макрофагально-моноцитарных клеток крови.
Кость формируется остеобластами. Основная их функция – синтез остеоида (протеинового матрикса), который на 90-95% состоит из коллагена 1 типа, на 5% из белка остеокальцина и впоследствии минерализуется кальцием и фосфатом из внеклеточной жидкости. ОБ содержат фермент щёлочную фосфатазу, несут рецепторы к паратиреоидному гормону (ПТГ) и кальцитриолу и способны к пролиферации. Минеральная часть кости состоит из гидроксиапатита и аморфного фосфата кальция, которые нековалентно связаны с белками органического матрикса
Резорбция кости осуществляется остеокластами. Это подвижные клетки. Выделяя протеолитические ферменты и кислую фосфатазу, вызывают деградацию коллагена, разрушение гидроксиапатита и выведение минералов из матрикса. Имеется корреляция между активностью тартратрезистентной кислой фосфатазы в сыворотке крови и выраженностью резорбтивных процессов в кости.
В норме оба процесса – образование и разрушение уравновешены.
Сроки физиологического ремоделирования кости.
| Фаза резорбции кости | 14-30 дней |
| Switch-over фаза (простагландин Е2 ответственен за апоптоз остекластов) | 10 дней |
| Фаза формирования кости | 90 дней |
| Фаза отдыха | 900 дней |
Биологический смысл феномена ремоделирования кости состоит в приспособлении механических свойств кости к постоянно меняющимся условиям окружающей среды. Рост и обновление скелета сопровождается регенерацией микроповреждений и поддержанием возможности перехода минералов в кровь и обратно. У взрослых людей остеобласты продуцируют чуть меньше костной ткани, чем требуется. Следствием этого является отрицательный баланс кости, который составляет 0,5-1% ежегодно. Данный феномен известен как «ассоциированная с возрастом остеопения».
Значительный прогресс в понимании остеокластогенеза был достигнут с открытием недавно новых членов семейства факторов некроза опухоли, их лигандов и рецепторов (RANKL-RANK-ОРG), которые играют ключевую роль в формировании, дифференцировке и активности ОК и могут быть молекулярными посредниками многих регуляторов. Молекулярная основа межклеточного взаимодействия может быть представлена следующим образом. RANKL (receptor activation of NF-kappa -ligand) — трансмембранный лиганд, экспрессированный на поверхности ОБ. Он продуцируется остеобластами и индуцирует процесс дифференцировки и созревания ОК. RANKL является основным стимулирующим фактором в образовании зрелых остеокластов. Поэтому увеличение экспрессии RANKL приводит к резорбции костной ткани и, следовательно, к потере костной массы.
OPG-остеопротегерин – остеокластингибирующий фактор, гликопротеин, широко экспрессированный в различных тканях, является мощным ингибитором костной резорбции. OPG действует для RANKL как «мнимый» рецептор, блокирует взаимодействие с RANK и таким образом ингибирует формирование зрелых ОК, нарушает процесс остеокластогенеза и резорбцию костной ткани. Баланс между RANKL и OPG фактически определяет количество резорбированной кости.
Недавно были получены данные, что Т-клетки принимают участие в регуляции костного метаболизма. При индукции интерлейкина-17 (IL-17),который в эксперименте индуцировал экспрессию СОХ-2-зависимого простагландина Е2 и RANKL в ОБ, авторы пришли к заключению, что IL-17 — важный цитокин для остеокластной резорбции. Однако наиболее важными медиаторами для действия различных систем в процессе ремоделирования костной ткани как в норме, так и при ОП является в настоящее время система RANKL-RANK-OPG.
Факторы, играющие важную роль в патогенезе ОП и его переломов: генетические, формирование низкого пика костной массы, потеря минеральной плотности кости, ассоциированная с возрастом и постменопаузой, нарушение архитектоники строения кости, особенности геометрии кости (бедра), травмы и падения, питание с низким содержанием кальция и витамина D, белка и др., низкая двигательная активность, вредные привычки (курение, алкоголь). При вторичном ОП к перечисленным факторам присоединяются факторы заболевания, отрицательного действия лекарственных препаратов (глюкокортикостероиды, иммунодепрессанты и др.), которые вызывают потерю костной массы и ОП.
Снижение костной массы при ОП, которое является основным фактором его патогенеза, рассматривается сегодня как следствие формирования неадекватно низкого пика костной массы в молодом возрасте и интенсивной потери кости, связанной с возрастом, в пожилом возрасте. Генетические факторы — главные детерминанты пика костной массы. Вклад генетических факторов составляет 60-80% в зависимости от методов исследования (близнецы, семьи). Различные гены рассматриваются в качестве кандидатов, участвующих в сложном процессе ремоделирования, формирования и эволюции костной массы, приводящих к ОП и переломам. Многочисленные комплексные исследования различных лабораторий мира направлены на поиск конкретных генов, изучение их полиморфизма, функции и взаимодействия в процессе костного ремоделирования и ОП.
Первичный остеопороз
Остеопороз, развивающийся в периоде постменопаузы, относится к классу первичных остеопорозов. Известно, что снижение секреции половых гормонов в период климактерия оказывает прямое и опосредованное влияние на состояние костного метаболизма. Снижение содержания эстрогенов приводит к нарушению кальциевого обмена, что сопровождается уменьшением минеральной плотности костной ткани. Кроме того, имеет место подавление активности остеобластов, что приводит к преобладанию резорбции над процессами формирования костной ткани. Постменопаузальный остеопороз составляет 85% общего количества первичного остеопороза.
Сенильный остеопороз — так называемый второй тип остеопороза, в патогенезе которого важную роль играет снижение всасываемости кальция в кишечнике, чему также способствует дефицит витамина D, вызванный уменьшением поступления его с пищей, замедлением образования его в коже из провитамина D. Наибольшее значение в патогенезе сенильного остеопороза имеет дефицит активных метаболитов витамина D вследствие снижения его синтеза в почках. При сенильном остеопорозе определённую роль играет развитие резистентности к витамину D — т.е. дефицит рецепторов 1,25(ОН)2D. Указанные факторы вызывают развитие транзиторной гипокальциемии, что приводит к усилению продукции паратиреоидного гормона. В результате вторичного гиперпаратиреоза усиливается резорбция костной ткани, в то время как костеообразование к старости снижено.
Вторичный ОП
Серьёзной медицинской проблемой является и вторичный ОП, возникающий при различных заболеваниях: ревматологических, эндокринологических, онкологических, обструктивных заболеваниях лёгких и бронхиальной астмы, заболеваниях почек, щитовидной железы, органов пищеварения, при иммобилизации и длительном приёме ряда медикаментов (кортикостероиды, иммунодепрессанты, антиконвульсанты, тиреоидные гормоны и др.).
Снижение МПКТ при вторичном ОП часто достигает критериальных величин ОП (-2,5 SD и более по Т-критерию) и даёт основание поставить диагноз.
У больных ревматоидным артритом (РА) в постменопаузе развитие ОП имело место в поясничном отделе позвоночника и шейке бедра у 36%, в предплечье у 40%, а у пациентов с сохранённым менструальным циклом — у 7 и 10% соответственно. Возраст больных и длительность менопаузы, наличие факторов риска, активность и длительность заболевания, степень функциональной недостаточности суставов, проводимая терапия (особенно назначение глюкокортикоидов — ГК) оказывают влияние на величину потери МПКТ и развитие остеопении. При обследовании больных с эндогенным гиперкортицизмом (синдром и болезнь Иценко-Кушинга) ОП обнаружен у 91%, переломы тел позвонков или рёбер — у 58%. ОП у больных бронхиальной астмой значительно утяжеляет течение основного заболевания, увеличивает стоимость лечения. По данным доктора И.А.Барановой, снижение МПКТ было выявлено у 42,8% больных бронхиальной астмой 20-49 лет, ранее не получавших гормональную терапию, и потеря МПКТ увеличивалась в 5 раз при среднетяжёлом течении (53,5%) по сравнению с легким (11%). У больных молодого и среднего возраста, принимавших ГК в средней дозе 10,20±5,99 мг/сут на протяжении 8-14 лет, снижение МПКТ обнаружено у 85%, у 13% зарегистрированы переломы скелета. В качестве причины развития ОП при РА, ряде воспалительных заболеваний, бронхиальной астме обсуждается непосредственное влияние самого заболевания на костную ткань, поскольку известно большое число общих цитокинов, принимающих участие в патогенезе хронического воспалительного процесса и костного ремоделирования, а также ГК, которые наиболее эффективны для базисной терапии при ряде системных заболеваний и в то же время занимающих ведущее место в индукции вторичного ОП. Изучение переломов при вторичном ОП остаётся актуальной задачей.
Стероидный остеопороз также относится к классу вторичных остеопорозов и вызывается патологическим повышением эндогенной продукции глюкокортикоидов надпочечниками или возникает при введении синтетических аналогов кортикостероидов, применяемых для лечения ревматологических, аллергических, гематологических, глазных болезней, заболеваний кожи, желудочно-кишечного тракта (ЖКТ), почек, печени. Стероидный остеопороз возникает при заболеваниях, характеризующихся повышенной секрецией кортикостероидов надпочечниками (Иценко-Кушинга).
Биохимические маркеры костного метаболизма
Их исследуют для оценки скорости протекания процессов костного ремоделирования и диагностики остеопороза с высоким или низким темпом костного обмена, разобщённости или дисбаланса его составляющих: костной резорбции и костеобразования. Разделение показателей на маркеры образования и резорбции кости является условным. Совместно они отражают итоговые изменения резорбции и костеобразования, направленные в ту или иную сторону.
Наиболее точными маркерами костного образования в настоящее время признают исследование содержания остеокальцина, коллагена 1 типа, остеопротегерина (OPG), Интерлейкина 17 в крови.
К маркерам резорбции костной ткани относят экскрецию оксипролина с мочой, определение пиридинолина, деоксипиридинолина и N-концевого телопептида в моче натощак, активность кислой тартратрезистентной фосфатазы, а также определение продуктов деградации коллагена 1 типа (Cross—Laps) и RANKL (receptor activation of NF-kappa -ligand) в крови.
Исследование маркеров костного ремоделирования целесообразно для:
1. Динамической оценки костного метаболизма;
2. Прогноза потери костной массы (вторичная профилактика при выявленной остеопении);
3. Прогноза перелома костей;
4. Отбора пациентов для проведения терапии;
5. Быстрого мониторинга терапии.
Процесс костного ремоделирования регулируется многими системными гормонами, цитокинами, факторами роста, идентифицированы многие локальные факторы костного ремоделирования. При изучении ОП важна оценка параметров минерального кальций-фосфор-магниевого обмена (уровень общего и ионизированного кальция, фосфора, магния, меди, цинка, витаминов С и К), которые вовлечены в процесс костеобразования.
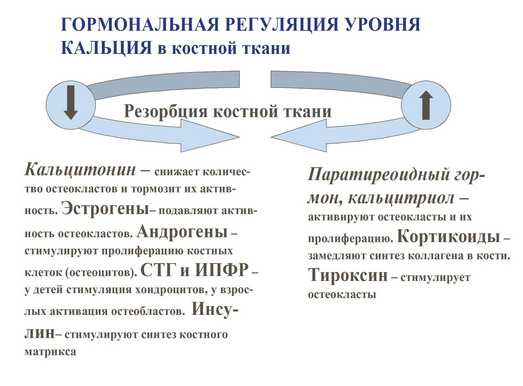
Гормональная регуляция уровня кальция в кости.
— паратиреоидный гормон – стимулирует резорбцию кости опосредованно воздействуя на остеокласты;
— кальцитонин – снижает количество остеокластов и тормозит их активность;
— эстрогены – подавляют активность остеокластов;
— андрогены – стимулируют пролиферацию остеоцитов и усиливают процессы костного синтеза;
— гормон роста и инсулинподобный фактор роста 1 (соматомедин-С) – активируют процесс синтеза кости за счёт стимуляции остеобластов;
— инсулин – стимулирует синтез костного матрикса;
— тироксин – стимулирует остеокласты, усиливая резорбцию костной ткани;
— кортикостероиды – замедляют синтез коллагена в костной ткани;
Из вышеперечисленного следует, что изучение уровня этих гормонов и маркеров костного ремоделирования на ранней стадии развития остеопении, особенно при вторичном ОП, позволит спрогнозировать и оценить вероятность дальнейшей резорбции костной ткани, провести профилактику ОП, назначить лечение.
Алгоритм лабораторной оценки костного ремоделирования.
| Показатель | Норма | Ед. изм | Остеопороз есть (?!) | |
| Кровь | ||||
| Паратиреоидный гормон | 7,0-53,0 | Пг\мл | >60 | |
| Кальцитонин | 3,0-13,0 | Пг\мл | <3,0 >15,0 | |
| Кальцитриол | 60,0-108,0 | пмоль\л | < 60,0 | |
| Остеокальцин | 3,1-13,7 | нг\мл | < 3,0 >22,0 | |
| Щёлочная фосфатаза | 39-117 | МЕ\л | < 25,0 | |
| Резистентная к тартрату кислая фосфатаза | 0-6,5 | МЕ/л | > 6,5 | |
| Кальций общий | 2,12-2,65 | ммоль\л | < 2,00 | |
| Кальций ионизированный | 1,15-1,27 | ммоль\л | < 1,0 | |
| Фосфор | 0,9-1,32 | ммоль\л | > 1,7 | |
| Магний | 0,7-1,15 | ммоль\л | < 0,65 | |
| Альбумин |
35-55 |
г\л |
< 30,0 |
|
|
Cross-Laps |
0,1-0,6 | нг/мл | > 0,7 | |
| Коллаген 1 типа P1NP | 15,2-50,0 | Нг/мл | < 10 > 100 | |
| Остеопротегерин | М –165+/-5Ж –184+/-5 | Пг/мл | < 140< 160 | |
| Лиганд активатора некротического фактораRANKL | М –1,66-2,18Ж – 2,78-3,29 | Пмоль/л | >2,5>3,5 | |
| Моча | ||||
| Кальций общий | 2,5-7,5 | ммоль\сут | >10,0 | |